导读
新冠疫情让mRNA疫苗走向世界舞台中央,从肿瘤到罕见病,这种技术在疾病治疗过程中显示出巨大的应用潜力。
“源创论坛”第二期活动聚焦于“核酸药物开发及应用前景”,此次活动由临平区经济信息化和科学技术局、杭州余杭经济技术开发区管委会创业创新局主办,浙大基础医学创新研究院、杭州市临平区生命健康产业协会、杭州源创生物医药科技有限公司承办,活动邀请了中山大学深圳研究院教授、珠海生码医学董事长杨海涛、中科院肿瘤与基础医学研究所研究院刘湘圣以及树兰俊杰资本蒋淑霞共同探讨核酸技术开发及应用前景。
为何mRNA技术能成为医学界的“新星”,无数科研人员和医药公司投身于此,也许从本次论坛中我们可以找到一些答案。本文以问答的形式,整理了三位嘉宾的分享内容。
问:mRNA平台技术在罕见病领域有哪些应用?
杨海涛:罕见病是mRNA蛋白替代治疗的一个转化应用方向。罕见病患者占据了世界人口的10%,这是一个非常大的市场。之前我们有很多关于肿瘤的研发,每年中国的肿瘤死亡人数为299万,罕见病人口数量也是非常大的,而且罕见病种类非常多,达到了7000多种。
如果我们能对罕见病进行早期治疗,对儿童也会有很大的帮助,罕见病不易被察觉,它缺乏有效诊断,通常需要很长时间才能发现。

所以罕见病的研发其实有非常大的应用场景。过去,因为遗传学工具的缺乏,罕见病开发十分困难,且成本高,患者人数少,开发临床数据不充足,所以mRNA技术可以在蛋白替代方面对很多罕见病进行治疗,这是一个非常大的赛道。一个罕见病的临床病例,可能只需要不到100例,研发成本比较低,如果mRNA技术在罕见病上快速发展,对企业和社会的健康管理都是一个很好的机会。

问:在新药开发上,mRNA技术平台涉及哪些环节?
杨海涛:mRNA技术在新药研发上涉及系统的整合,它是多学科的交叉融合,不同的环节涉及不同的学科,比如在上游的序列修饰方面,可能涉及到分子生物学、病理学、免疫学、微生物学、人工智能、生物信息学等。
在递送过程中,可能涉及纳米材料学、有机合成学、分子生物学。在临床期,可能涉及药理学、毒理学、传染病学、肿瘤学和临床医学等。
在工艺方面,涉及材料学、生物工程学、自动化等,在mRNA疫苗生产过程中,涉及的材料和设备是相当多的,包括质粒DNA、PEG脂质等。
mRNA疫苗的整个研发过程,实际上是一个系统工程。可能每个初创企业或者研究室只能聚焦其中一个环节,等到发展为上市公司后才有能力进行全部流程。

问:在开发疫苗和药物上,目前mRNA技术会有哪些瓶颈?

杨海涛:这其中涉及的技术瓶颈和关键要点是比较多的。首先是疫苗和药物的优化设计问题,比如传染病,我们需要设计疫苗产生有效的综合抗体,使抗体达到一定的滴度,能够起到防御病毒的作用。优化设计对于肿瘤疫苗、罕见病以及其他细胞治疗涉及的问题可能更多。
以肿瘤疫苗为例,涉及到多种肿瘤抗原问题,如如何使疫苗调动免疫系统、如何克服免疫逃逸作用、如何调节免疫系统不产生过度免疫、细胞因子风暴等。在药物的优化过程中,涉及到人工智能的应用,人工智能对序列进行优化,能够增强免疫原性,增强抗体表达的稳定性。
其次,要使疫苗更安全有效,并且降低成本。现在已经通过纳米脂质递送系统保证了一定的安全性,接下来,我们需要更好地完善疫苗和药物的递送系统。对于肿瘤疫苗,我们也期望能够递送到特定的器官和组织细胞中,以后的递送系统可能走向自动化、智能化和标准化。
最后,疫苗的技术瓶颈就是要具备快速生产和制备能力。未来的目标,就是对传染病疫苗的响应时间为六个月,肿瘤是两年,对其他药物也是两到三年,这个要求目前只有使用mRNA技术才能够达到。
问:未来mRNA技术有哪些应用前景?
杨海涛:AI技术在疫苗方面的应用在逐渐深入,预测RNA的结构,对改变它的结构效应、药物的结合靶点、蛋白质的免疫调节功能有很好的预测,加大这方面的投入和研发,是十分有前景的。
对于肿瘤疫苗的研究,最重要是肿瘤新抗原的确定。每一种肿瘤可能有十几个驱动基因,那么相关的突变基因大概有上万个,如何对这些突变产生相应的免疫性是很大的挑战。现在肿瘤疫苗的研发方向是肿瘤相关抗原和新抗原,这样才有可能产生有效的肿瘤疫苗。然而,新抗原的筛选是一个非常困难的事情,在1000个突变中,能够被T细胞识别的靶点数量很小,识别后成为肿瘤新抗原再产生T细胞的识别,只有百分之零点几。所以我们需要建立一个平台,能够快速筛选有效的肿瘤新抗原。

我们公司也在做这方面的研究,在对肿瘤新抗原的预测中,通过现有数据,依据算法预测要开发的新抗原。我们希望完成一个新的抗原文库,为未来的开发做一个数据基础。
问:国内mRNA疫苗产业链,如何形成合力,共同推进该技术的发展?
杨海涛:mRNA疫苗的设计流程复杂,涉及因素众多,我们需要慢慢把流程标准化、智能化,形成一个完整的产业群。最重要的是,对于肿瘤疫苗的免疫机制我们还存在很多空白,每一种肿瘤有不同的信号通路和关键免疫调节因子,这些都在逐步完善中。


我们可以看到国内有很多做这些疫苗的公司,比如传统的智飞生物、华南生物等。核酸药物技术出现后,也出现了一系列的新公司,比如艾博生物、斯微生物等。
我国是一个非常大的疫苗市场,以前我们的疫苗产业发展是比较弱的,接下来,我们要借着mRNA技术的拓展和成熟的机会,让我们国家的医疗产业能弯道超车。
问:核酸适体药物是什么,有哪些临床应用?
刘湘圣:核酸适体是一类由短链的碱基组成的、能够特意识别靶标的DNA或RNA结构,它与传统抗体相比有高亲和力、高特异性等特点,同时它的尺寸较小,是一种可以通过化学合成制备的适体。另一个特点是,它能够通过体内外筛选的手段从随机文库里获得,经过不断的筛选和结合,获得对靶细胞有高亲和力的核酸适体。无论从临床还是基础研究上看,核酸药物都是未来一个非常重要的方向。
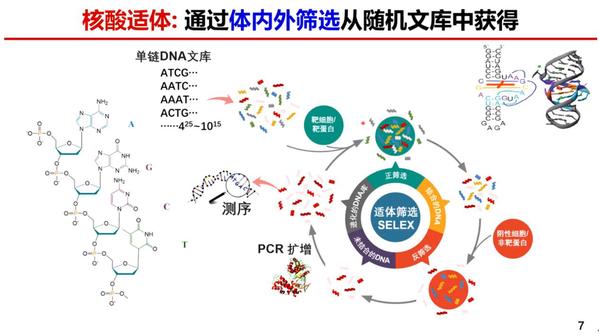
核酸适体可以作为药物,通过核酸适体控制特定的蛋白,从而治疗不同的疾病。另一方向是能够像抗体一样去结合特定的靶标,作为一个靶向递送系统。靶向显影已经开展首个临床试验,我们在上海的仁济医院治疗了多例病人,证明了核酸适体药物的安全性考量。除此之外,未来的应用方向更多为核酸适体药物偶联物(Aptamer Drug Conjugate ,ApDC)
核酸适体能够被化学精准合成,这能够帮助我们定点定量修饰适体药物分子。这些研究的出发点是通过特定的化学偶联,连接核酸试剂靶向分子,给临床药物加上靶向。核酸最大的特点是能够通过固相合成的方式把一些药物做成核苷酸类型的单品,通过这种方式精准定量合成,能够深入研究不同药物的配比在临床的应用。
问:目前,mRNA技术平台递送系统存在哪些问题,您是如何思考的?
刘湘圣:相比小核苷酸,mRNA是一个分子量非常大的序列,如何高效递送和表达是关键,并且载体的安全性也十分重要。mRNA疫苗项目有两大技术壁垒,一是mRNA序列设计,如何降低疫苗的免疫原性,高稳定性和高效表达;另一个是如何实现高效递送系统,在这样一个过程中,我们要做一个自己的mRNA平台,要做自己设计的递送系统,建立了这样的平台后,如何去拓展未来的应用,真正服务于病人和社会。
制材和纳米制备工艺对于mRNA递送系统是十分关键的。在不同的微流控设备下,体内表达会有很大的差异,所以说这种工艺需要各个层面的符合;另一方面,我们的仪器还不够,并且配合不同的透析纯化条件,最终形成的纳米颗粒是明显不同的,这样会导致最后体内表达的差异也是相当大的。我们需要思考如何去优化条件,如何设计一个高效的mRNA递送系统,如何使用AI技术帮助我们。
要做到更高效、更精准、更安全的递送系统,但这里面有很多关键的问题,比如说我们如何实现这种肝外器官靶向,如何在组织层面、组织内、细胞层面实现更精准的靶向,这是可能是当我们在遇到更具体的疾病研究过程中,需要去一步一步从技术研究逐步解决的问题。
问:从mRNA开发、序列设计和药物递送方面,国内外的差距是怎样的?
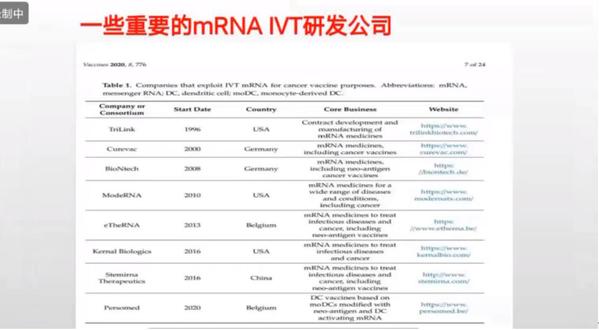
杨海涛:目前,国内外的差距还是挺大的,我国最早做的公司是两家,一家是斯微生物,还有一家是星河生物。我们只发展了不到五年的时间,这造成了哪些差距,首先是我们没有源头的原创技术,从序列实际上说,去年没有一家公司做系统设计的优化,整体来说,生物医学的数据和序列基本上掌握在国外手里;第二点是在递送的专利上,递送专利是我们是没有拿到任何原创东西。在mRNA研发中,我们可以用公开的配方,但是一旦进入生产,我们要给对方交专利费。国内也有自主研发的递送系统,最早斯微生物做了一个蛋白膜(LPP),但还不具备实用性。
接下来还有很多,我们在原底层技术上可能无法突破,如果mRNA技术成为主流,我们可以进行改造,比如靶向技术,但在序列设计和优化方向我们还是有一些机会的。因为肿瘤类型比较多,有100多种,每一种都不一样。我认为我们不一定要追求完全的独立自主,因为在生物医药方面我们的积累比较慢。
问:现在药物递送系统有许多种载体,这方面发展前景如何?
蒋淑霞:每种载体都有它的优势以及可能没办法做到的地方,我们主要从临床问题出发,看药物递送到组织目前还面临哪些问题,哪一种递送系统可以解决这个问题。我们主要是从这些角度看发展前景。
比如LNP递送系统,它是最适合于mRNA、siRNA的递送。像外泌体这类,免原性比较低,有天然的组织趋向性,目前主要存在大规模生产和纯化比较困难,将外泌体适用于递送药物,一些初创公司正在探索,但目前在装载药物的技术上还存在着壁垒。
总的来说,mRNA技术以及它的递送系统经历了许多年的研究,但这依旧是一项非常新的技术。从新冠疫苗到未来的核酸适体药物,我们期待着国内在这方面的进步。
嘉宾简介
